Zellfreie Proteinsynthese
Für die Entwicklung von Bioprozessen ist das Screening geeigneter Biokatalysatoren unerlässlich und eine komplexe Aufgabe [1]. Daher ist das Ziel meiner Studie die Entwicklung eines Hochdurchsatz-Screening-Systems für Biokatalysatoren. Der geschwindigkeitsbeschränkende Schritt bei der Generierung von Biokatalysatorbibliotheken ist in der Regel die heterologe Expression und die Proteinaufreinigung. Daher kann die Verwendung der zellfreien Proteinsynthese (CFPS) in einem automatisierten Setup diesen Engpass umgehen und die Effizienz der Bioprozessentwicklung erhöhen.
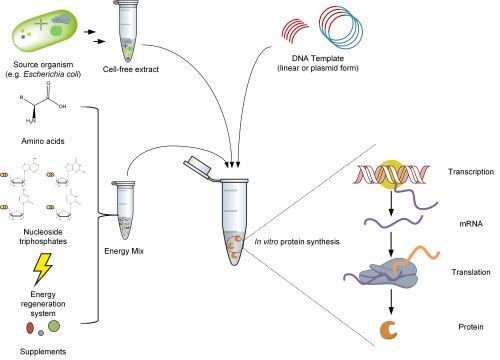
Zellfreie Systeme werden seit Jahrzehnten für die Proteinsynthese verwendet und bieten eine breite Palette von Anwendungen und mehrere Vorteile im Vergleich zur heterologen Expression. Proteine können aus DNA-Vorlagen innerhalb weniger Stunden mit Konzentrationen im Milligramm-pro-Milliliter-Bereich hergestellt werden [2]. Der CFPS-Mix besteht aus drei Teilen:
- Einem zellfreien Extrakt, der alle notwendigen Bestandteile für die gekoppelte Transkriptions- und Translationsmaschinerie enthält, wie Ribosomen, Aminoacyl-tRNA-Synthetasen und Translationsfaktoren für Initiation, Elongation und Produktfreisetzung.
- Die DNA-Vorlage mit dem gewünschten Gen.
- Ein Energiemix mit den Bausteinen für die mRNA und die Proteinsynthese sowie zusätzlichen Kofaktoren und Supplementen.
Die rationelle Verbesserung der ergänzenden Komponenten führt zu Systemen, die neuartige CFPS-Anwendungen jenseits reiner Forschungsinteressen ermöglichen. Die Integration von CFPS in Plattformen für Enzymscreening und -analyse im Hochdurchsatz kann daher als leistungsfähiges und vielseitiges Werkzeug für die schnelle Entdeckung neuer Kandidaten oder verbesserter Biokatalysatorvarianten dienen.
[1] Lütz, S., Giver, L., & Lalonde, J. (2008). Engineered enzymes for chemical production. Biotechnology and Bioengineering, 101(4), 647–653. doi
[2] Caschera, F., & Noireaux, V. (2014). Synthesis of 2.3 mg/ml of protein with an all Escherichia coli cell-free transcription-translation system. Biochimie, 99(1), 162–168. doi